Essai visant à évaluer un anticorps expérimental, seul ou en combinaison avec pembrolizumab, pour le traitement de patients atteints de tumeurs solides avancées ou métastatiques (VISTA).
Essai visant à évaluer un anticorps expérimental, seul ou en combinaison avec pembrolizumab, pour le traitement de patients atteints de tumeurs solides avancées ou métastatiques (VISTA).
Étude de phase I internationale multicentrique d’escalade de dose et d’expansion de dose du W0180 en monothérapie ou en association avec le pembrolizumab (anti-PD-1) chez des participants adultes atteints de tumeurs solides localement avancées ou métastatiques.
Comment l'essai se déroule-t-il ?
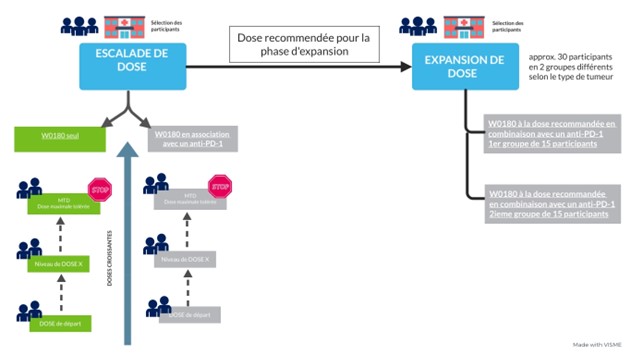
La phase d’escalade de dose inclura jusqu’à 39 participants. Des doses croissantes de W0180, seul ou associé au pembrolizumab seront administrés à des groupes successifs de participants.
Un maximum de 30 participants présentant des types de tumeurs spécifiques sera inclus dans la phase d’expansion. Ces participants recevront les doses déterminées lors de la phase d’escalade.
Le schéma ci-dessous résume la conception de l’étude :
Qui peut participer à cet essai ?
Pour participer à cet essai, les sujets doivent répondre à différents critères, parmi lesquels :
• Participants adultes atteints de tumeurs solides métastatiques ou localement avancées et présentant les spécificités suivantes selon la phase de l’essai :
- Pour l’escalade de dose en association avec du pembrolizumab et pour l’expansion de dose uniquement : participants dont la maladie ne répond plus à une certaine classe d’immunothérapies
- Pour la phase d’expansion uniquement : participants présentant des tumeurs exprimant le récepteur VISTA
• Participants ne répondant pas au traitement standard ou pour lesquels aucun traitement standard n’est disponible ou adapté
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Le principal objectif est de déterminer une dose de W0180 qui soit la mieux tolérée et recommandée pour la suite du développement clinique.
Le premier objectif est d’identifier la dose maximale tolérée (DMT), autrement dit la plus forte dose de W0180 (seul ou en association avec le pembrolizumab) pouvant être administrée sans entraîner de risque majeur pour la santé du participant. Pour déterminer la DMT, des doses croissantes sont administrées à différents groupes de participants (niveau de dose), jusqu’à trouver la dose la plus élevée ayant des effets secondaires acceptables. En fonction de la DMT sélectionnée et de l’ensemble des informations obtenues pendant la phase d’escalade de dose, une dose de W0180 sera recommandée pour la phase d’expansion.
Cet essai permettra également :
- De décrire le profil de tolérance du W0180 (seul ou en association avec du pembrolizumab) en évaluant le nombre et le type d’effets secondaires
- De décrire la façon dont le traitement entre dans l’organisme, circule dans le sang, et est finalement éliminé.
- De fournir des données préliminaires sur l’activité du W0180 (seul ou en association avec du pembrolizumab) sur les tumeurs cancéreuses
Quels sont les traitements à l’étude et comment sont-ils administrés ?
W0180 est un anticorps thérapeutique.
Un anticorps est une molécule du système immunitaire capable de reconnaître un récepteur spécifique à la surface d'une cellule et de s'y fixer.
Le récepteur ciblé est ici le récepteur VISTA. En s’y fixant, W0180 devrait stimuler le système immunitaire et renforcer sa capacité à combattre les cellules cancéreuses. Cette capacité antitumorale potentielle pourrait être renforcée avec l’association d'autres anticorps thérapeutiques connus, notamment d'autres immunothérapies telles que le pembrolizumab.
Le pembrolizumab est une immunothérapie anticancéreuse. Il s’agit également d’un anticorps thérapeutique.
Les participants traités par W0180 seul recevront une dose par semaine.
Les participants traités par W0180 en association avec le pembrolizumab recevront une dose de W0180 par semaine, et une dose de pembrolizumab toutes les 3 semaines. Les deux traitements débuteront le même jour.
Tous les traitements sont administrés par voie intraveineuse.
Les participants recevront le traitement tant que celui-ci est efficace, autrement dit tant que la maladie ne progresse pas, et tant qu’il est bien toléré, avec un maximum de 35 doses pour le pembrolizumab.
