
Pourquoi participer à un essai clinique ?
Les essais cliniques sont indispensables pour évaluer les effets d’un traitement et déterminer s’il est bien toléré et efficace avant d'autoriser sa prescription.
Participer à un essai clinique permet d'expérimenter un traitement et de le développer en vue d'améliorer la prise en charge d'une pathologie ou de soigner une maladie. Par traitement, on entend l'administration de nouveaux candidats médicaments seuls ou combinés à d'autres ou encore selon de nouvelles modalités. On peut aussi entendre par traitement, de nouveaux dispositifs médicaux. Les résultats de la recherche clinique et des essais cliniques conditionnent les progrès de la médecine en faisant du patient le centre du processus. Ces essais, conduits avec rigueur et méthode garantissent un bon niveau de preuves scientifiques.
Tout patient ou volontaire sain peut participer à un essai clinique, sous réserve de répondre aux critères propres à chaque étude.
En tant que volontaires sains, les participants contribuent à faire avancer la médecine et la recherche dans différents domaines scientifiques.
En tant que patients, les participants peuvent avoir accès à un traitement innovant qui n’est pas encore proposé dans la pratique médicale courante, et bénéficier du suivi d’équipes médicales expérimentées.
Sans cette participation aux essais cliniques, de futurs patients ne pourraient pas voir la prise en charge de leur maladie améliorée voire espérer une guérison, gage d'une profonde amélioration de leur qualité de vie.
Pourquoi a-t-on besoin d’un grand nombre de participants ?
Chaque individu est unique et peut réagir différemment à un traitement, l'action de ce dernier peut varier d’un patient à l’autre. De la même manière, des participants présenteront certains effets secondaires et d’autres non.
Du fait de la variabilité entre les individus, les informations propres à chaque patient jouent un rôle essentiel mais ne suffisent pas à prouver l'efficacité et la tolérance du traitement de manière exhaustive.
C’est pourquoi il est nécessaire de regrouper les données de l'ensemble des participants d'un même essai et aussi de combiner plusieurs essais pour obtenir des résultats probants et fiables.
En savoir plus:
Le nombre de participants à inclure est défini dans le protocole et directement lié à l'objectif principal de l'essai. Grâce aux hypothèses cliniques et aux méthodes statistiques, les scientifiques déterminent le nombre de participants nécessaires pour répondre à la question posée avec suffisamment de certitude.
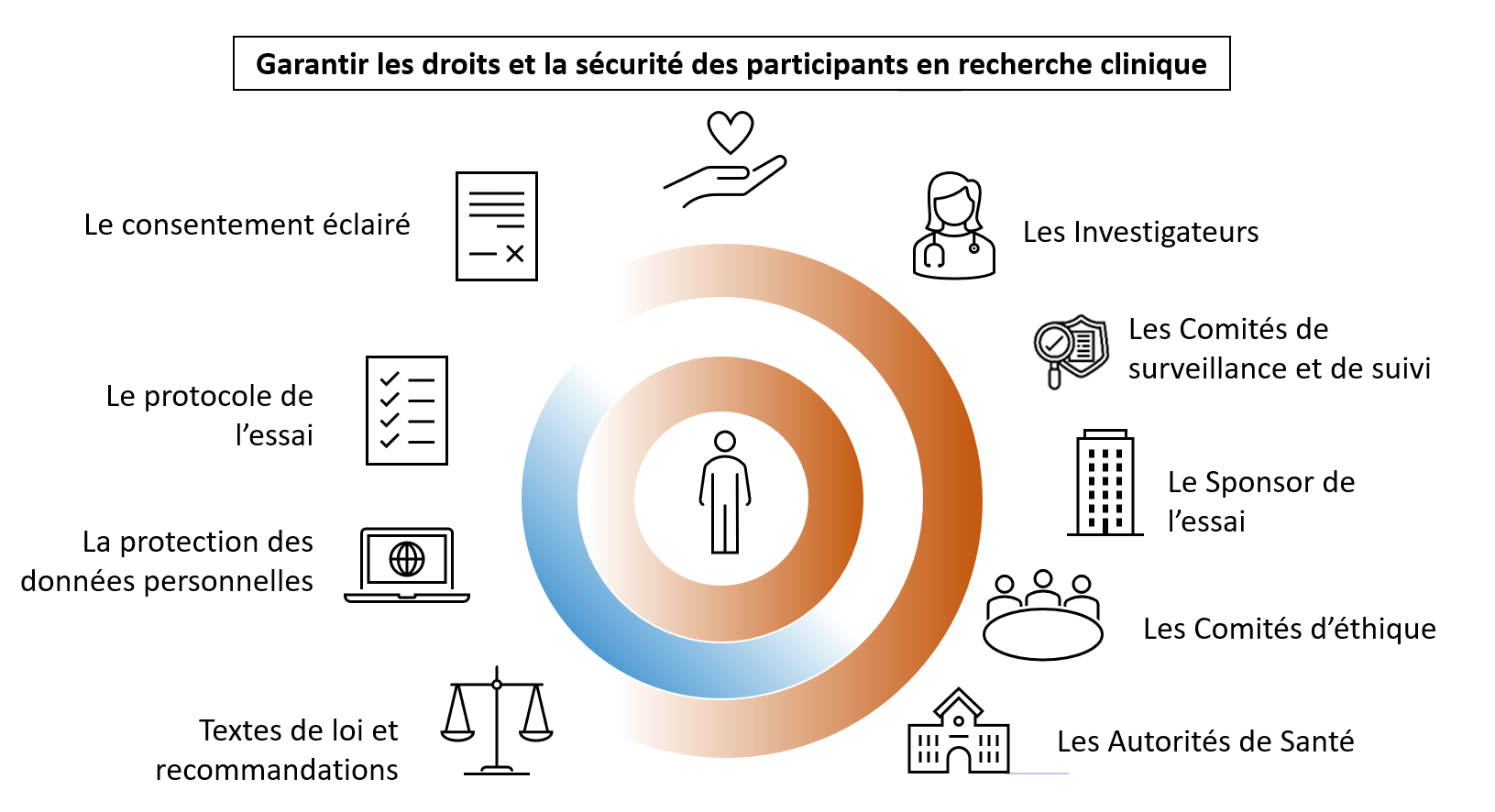
Comment les participants sont-ils protégés ?
La protection des participants, préoccupation majeure de la recherche clinique, est régie par des textes de loi fondateurs et des recommandations.
La recherche clinique est menée selon les principes humanistes et éthiques qui régissent la pratique médicale. Elle doit respecter des normes, des exigences réglementaires nationales et internationales qui garantissent la protection des participants aux essais cliniques. L'ensemble de ces réglementations a pour but de protéger et de garantir les droits, la sécurité et le bien-être de tous les participants (mineurs, majeurs sous protection juridique, adultes, personnes malades ou vulnérables, volontaires sains), ainsi que leurs données et échantillons biologiques (sang, tissus, organes). L'intérêt des participants doit toujours passer avant ceux de la science et de la société. De plus, de nombreuses entités assurent la surveillance des essais cliniques tout au long de leur déroulement, comme les autorités sanitaires, les comités d’éthique ou les comités de surveillance et de suivi.
Protéger les participants implique également de préserver leur vie privée (5,6), de garantir la confidentialité des informations recueillies, de permettre aux participants de conserver leur anonymat, de fournir les informations pertinentes au sujet de l’essai au moment de l’obtention du consentement éclairé, de permettre aux participants de poser des questions sur l'essai et d’interrompre leur participation à l’essai à tout moment.
Liens vers les textes et les directives:
- Bonnes pratiques cliniques pour les recherches biomédicales: Bonnes pratiques cliniques
- Déclaration d’Helsinki: Déclaration d’Helsinki
- Directives européennes : directive 2001/20/CE et Directive 2005/28/CE
- Règlement européen 536/2014 : Règlement européen 536/2014
- Règlement général sur la protection des données : RGPD
- FDA: Code of Federal Regulations (anglais)
