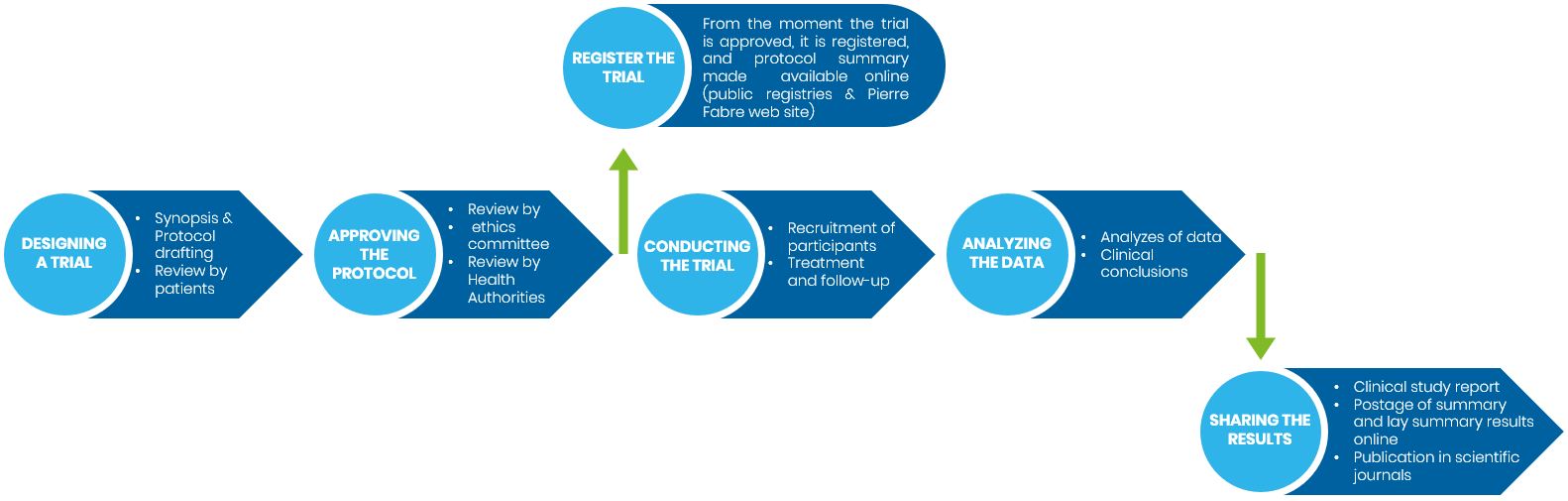
Comment les essais cliniques sont-ils conçus ?
Les essais cliniques doivent être bien conçus afin de pouvoir répondre à des questions essentielles de la recherche clinique et contribuer à l’amélioration des soins aux patients. Cela implique de multiples intervenants et plusieurs étapes, qui vont de la conception de l’essai jusqu’à la présentation et la publication des résultats.
1.
Création/conception d’un essai
Création/conception d’un essai
Avant le début d'un essai clinique, un plan détaillé (appelé protocole) est rédigé par le promoteur, qui décrit le rationnel et les objectifs de l’essai, ainsi que la façon dont il sera mené. Ce plan comprend :
- Le titre complet et le titre abrégé de l’essai,
- Le promoteur et les collaborateurs,
- La description du type de l'essai, par exemple, un essai interventionnel de phase III randomisé en aveugle,
- La description des objectifs et les critères d'évaluations associés déclinés comme principaux ou secondaires selon leur importance dans l'étude
- Les informations détaillées sur les personnes qui peuvent ou ne peuvent pas participer à l’essai, recensées dans les critères d’éligibilité,
- Le traitement ou l’association de traitement à tester, le ou les médicaments de comparaison, le cas échéant, et leur dosage,
- La durée de l’essai,
- Les modalités de suivi, prise en charge et déclaration des effets secondaires
- Les règles et méthodes qui seront suivies pour conduire l’essai,
- Les modalités d'évaluation et de présentation des résultats.
Le protocole a pour objectifs d'assurer que l’essai se déroule de façon éthique, de garantir la sécurité des participants tout au long de l’essai et d'évaluer les bénéfices et les risques du nouveau traitement visant à prévenir ou traiter les maladies.
Une synthèse des principales informations contenues dans le protocole est également mise à disposition dans un document technique, intitulé synopsis, et dans un document compréhensible par le public, intitulé résumé vulgarisé du protocole.
Le protocole est revu par des associations de patients, conformément à la réglementation européenne relative aux essais cliniques, de façon à tenir compte, dans la mesure du possible, de l’avis des patients dans la conception des essais cliniques, notamment pour alléger la charge incombant aux futurs participants.
2.
Revue et approbation du protocole proposé
Revue et approbation du protocole proposé
La réalisation d'un essai clinique est soumise à l'approbation d'un comité d'éthique indépendant ainsi qu'à l'accord des autorités de santé du ou des pays où il doit se dérouler. Ces démarches permettent de garantir que le promoteur respecte les exigences réglementaires et les recommandations visant à protéger la sécurité et les droits des participants, telles que les Bonnes pratiques cliniques (BPC) et la protection des données personnelles des participants, notamment en Europe, conformément au Règlement général sur la protection des données (RGPD).
3.
Inscription de l’essai dans les registres publiques
Inscription de l’essai dans les registres publiques
Une fois le protocole approuvé, l’essai doit être inscrit dans au moins un des registres d’essais cliniques (une base de données consultable en ligne, comme le registre des essais cliniques de l’UE pour l’Europe ou clinicaltrials.gov pour les Etats-Unis) rendant publique et consultable les informations relatives à l’essai en cours, ses résultats intermédiaires (le cas échéant) et ses résultats finaux lorsqu’il est terminé.
4.
Sélection des participants et déroulement de l’essai
Sélection des participants et déroulement de l’essai
Les patients, ou volontaires sains, éligibles sont tout d’abord informés des détails de l’essai dans le cadre de l’obtention du consentement éclairé. Une fois le consentement signé, les participants sont inclus dans l'essai. Les participants devront suivre les instructions et assister aux visites programmées conformément au protocole. Des comités de protection des personnes et des comités de surveillance et de suivi s’assureront que les participants sont protégés tout au long de l’essai.
Le promoteur peut adapter ou modifier le protocole initial au cours de l’essai. On parle alors d’amendement, qui doit lui aussi être soumis aux autorités sanitaires et au comité d’éthique pour approbation.
Si vous envisagez de rejoindre un essai clinique, consultez notre page répertoire des études cliniques ou, si vous souhaitez en savoir plus sur la marche à suivre pour rejoindre un essai clinique et sur le parcours d’un participant à un essai, consultez notre page parcours du patient.
5.
Analyse des données
Analyse des données
Les données sont issues de mesures telles qu’un examen clinique, des analyses de sang, de l’imagerie médicale, comme les radios, et de questionnaires remplis par les participants ou les investigateurs.
Une fois l’essai terminé, les données des participants sont anonymisées, agrégées et analysées par des statisticiens pour le compte du promoteur afin d’obtenir les résultats de l’essai. Ces derniers sont évalués et des conclusions sont tirées pour déterminer si l’étude a rempli ses objectifs, et si elle a démontré que le traitement testé est sûr et, selon la phase de l'étude, efficace. Cette étape peut prendre plusieurs mois, selon le volume de données recueillies au cours de l’essai.
6.
Rapport et publication des résultats à l’intention des investigateurs, des participants et du grand public
Rapport et publication des résultats à l’intention des investigateurs, des participants et du grand public
Un rapport scientifique détaillant les conditions de réalisation et les résultats de l'essai est rédigé suivant les recommandations internationales. On l’appelle le rapport d’étude clinique. Celui-ci est élaboré à la fin de l’essai ou quelque temps avant, à des moments définis dans le protocole, notamment lorsque l'objectif principal est évaluable, comme en oncologie, où un essai peut durer plus de 10 ans.
Les résultats font l'objet d'articles publiés dans des revues médicales et présentés lors de congrès scientifiques consultables moyennant des frais ou en libre accès. De plus en plus souvent, les résultats sont aussi mis à disposition du grand public grâce à des synthèses vulgarisées, rédigées dans un langage simple et sans jargon technique et dans la langue des participants à l’essai.
Ces synthèses sont mis à disposition en même temps que les résultats de l’étude clinique, sur les sites internet publics tels que le registre des essais cliniques de l’UE, et peuvent être téléchargées ici (consultez notre page répertoire des études cliniques). Les synthèses de résultats vulgarisées sont également partagées avec les organisations de patients concernées.
Apercu du processus d'un essai clinique