Essai d’un nouveau traitement destiné aux patients atteints de tumeurs cancéreuses solides avancées ou métastatiques (Ulysse)
Essai d’un nouveau traitement destiné aux patients atteints de tumeurs cancéreuses solides avancées ou métastatiques (Ulysse)
Étude de phase I/II d'escalade de dose en ouvert et étude d'expansion de dose portant sur W0101, un conjugué anticorps-médicament, administré en perfusion intraveineuse chez des participants atteints de tumeurs solides avancées ou métastatiques. Étude multicentrique internationale en ouvert.
Comment l'essai se déroule-t-il ?
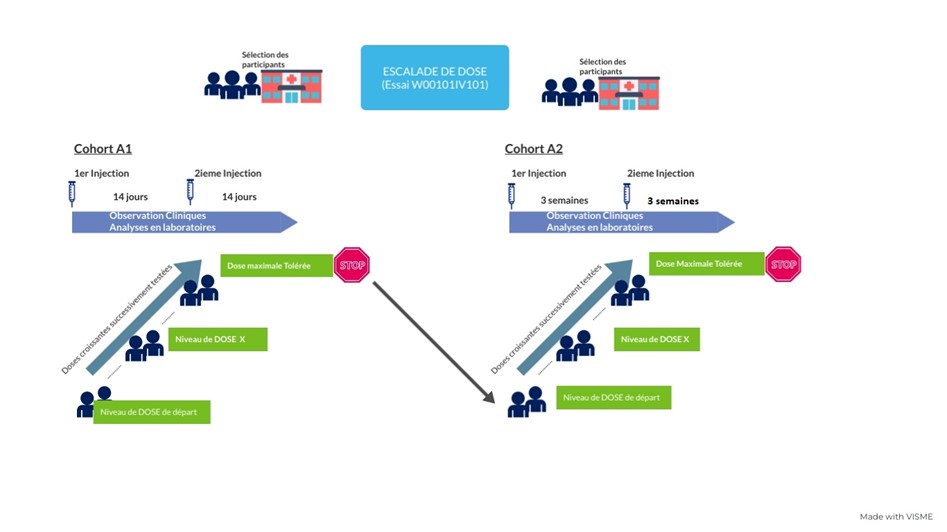
Pendant la phase I, 2 schémas d’administration seront successivement testés sur 2 groupes de participants (les cohortes) :
- 20 participants seront inclus dans la première cohorte (A1)
- 14 participants seront inclus dans la deuxième cohorte (A2)
La conception de la seconde partie de l’essai (Phase II) sera définie lorsque les résultats de la phase I seront disponibles.
Ce schéma synthétise les informations présentées ci-dessus :
Qui peut participer à cet essai ?
Pour participer à cet essai, les sujets doivent répondre à différents critères, parmi lesquels :
• Adultes présentant des tumeurs cancéreuses solides avancées ou métastatiques confirmées. Selon les cohortes A1 et A2 certains types de cancers seront privilégiés .
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Le principal objectif de cet essai est de déterminer la dose maximale tolérée (DMT), autrement dit la plus haute dose de W0101 pouvant être administrée sans exposer le participant à un risque majeur pour sa santé.
Pour déterminer la DMT, des doses croissantes sont administrées à différents groupes de participants (niveau de dose), jusqu’à trouver la dose la plus élevée associée à des effets secondaires acceptables.
Cet essai permettra également :
- De décrire le profil de tolérance de W0101 en évaluant le nombre et le type d’effets secondaires
- De décrire la façon dont le traitement est absorbé, circule dans l’organisme et est finalement éliminé.
- De fournir des données préliminaires sur l’activité de W0101 sur les tumeurs cancéreuses
Quels sont les traitements à l’étude et comment sont-ils administrés ?
Le W0101 (lonigutamab ugodotin) est un anticorps-conjugué à un médicament (ADC).
Un ADC est composé d’un anticorps lié à un agent anticancéreux (médicament cytotoxique). Un anticorps est une molécule du système immunitaire capable de reconnaître un récepteur spécifique exprimé à la surface d’une cellule tumorale (ici l'IGF-1R) et de s'y fixer. Une fois lié, l’agent anticancéreux a la capacité de tuer la cellule cancéreuse tout en épargnant les cellules saines de l'organisme, limitant ainsi les effets secondaires de la chimiothérapie.
Ce traitement sera administré par voie intraveineuse (perfusion) selon 2 schémas d’administration :
- Cohorte A1 : toutes les 2 semaines
- Cohorte A2 : toutes les 3 semaines
Les participants peuvent recevoir le traitement par W0101 tant que celui-ci est efficace, autrement dit tant que la maladie ne progresse pas, et tant qu’il est bien toléré.
