Étude de phase II multicentrique en ouvert avec phase de test de la tolérance (safety lead-in) évaluant l’efficacité, la tolérance et la pharmacocinétique de l’association encorafénib et binimétinib chez des participants chinois atteints d’un cancer du poumon métastatique non à petites cellules avec mutation BRAFV600En’ayant pas reçu de traitement préalable par inhibiteurs de BRAF et de MEK
Étude de phase II multicentrique en ouvert avec phase de test de la tolérance (safety lead-in) évaluant l’efficacité, la tolérance et la pharmacocinétique de l’association encorafénib et binimétinib chez des participants chinois atteints d’un cancer du poumon métastatique non à petites cellules avec mutation BRAFV600En’ayant pas reçu de traitement préalable par inhibiteurs de BRAF et de MEK

Étude de phase II multicentrique en ouvert avec phase de test de la tolérance (safety lead-in) évaluant l’efficacité, la tolérance et la pharmacocinétique de l’association encorafénib et binimétinib chez des participants chinois atteints d’un cancer du poumon métastatique non à petites cellules avec mutation BRAFV600En’ayant pas reçu de traitement préalable par inhibiteurs de BRAF et de MEK.
Comment l'essai se déroule-t-il ?
Au moins cinquante-cinq (55) participants adultes chinois atteints d’un cancer du poumon métastatique non à petites cellules avec mutation BRAFV600E participent à cet essai en ouvert.
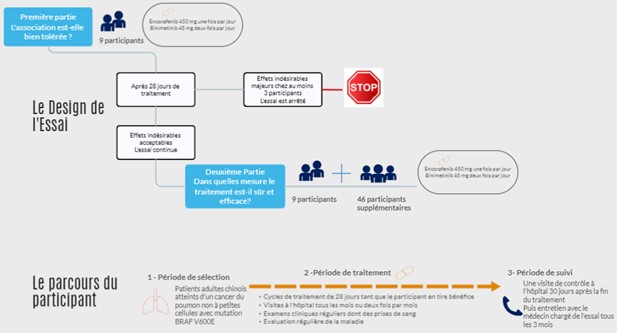
Première partie de l’essai :
Neuf (9) patients participent à la première partie de cet essai et sont traités par encorafénib et binimétinib. Après 28 jours (un cycle) de traitement, la tolérance à l’encorafénib et au binimétinib est évaluée chez ces neuf participants.
Si au moins trois (3) participants présentent un effet secondaire majeur, la tolérance est considérée comme insuffisante et l’essai est arrêté.
Si le traitement est considéré comme suffisamment sûr, la seconde partie de l’essai peut alors commencer.
Deuxième partie de l’essai :
Quarante-six (46) participants supplémentaires sont inclus à l’essai et traités par encorafénib et binimétinib.
Si les effets secondaires sont considérés comme acceptables, tous les participants sont traités par encorafénib et binimétinib jusqu’à ce qu’ils n’en tirent plus de bénéfices, autrement dit jusqu’à la progression de la tumeur ou du cancer.
Une période de suivi débute à l’arrêt du traitement. Cette période consiste à surveiller la santé des participants dans le temps, que ce soit par le recueil d’informations sur l’état de santé ou la réalisation d’examens cliniques, d’analyses sanguines ou d’examens d’imagerie médicale.
Ce schéma synthétise les informations présentées ci-dessus :
Qui peut participer à cet essai ?
Pour participer à cet essai, les sujets doivent répondre à différents critères, parmi lesquels :
• Participants chinois âgés de ≥ 18 ans pour la Chine continentale, de ≥ 20 ans pour Taïwan et atteints d’un cancer métastatique du poumon non à petites cellules
• La tumeur ne peut être retirée par chirurgie
• La tumeur présente une mutation génétique spécifique appelée mutation BRAFV600E
• Le participant a déjà reçu un seul ou aucun traitement pour son cancer métastatique
• Le participant n’a jamais reçu les traitements à l’étude
• Le participant n’est pas enceinte ou allaitante.
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Pour la première partie de l’essai, le principal objectif est le suivant :
• Évaluer la tolérance (effets secondaires) de 450 mg d’encorafénib et de 90 mg de binimétinib chez des participants chinois atteints d’un cancer du poumon métastatique non à petites cellules avec mutation BRAFV600E. Pour ce faire, on compte le nombre de participants ayant présenté un effet indésirable majeur dans les 28 premiers jours de traitement.
Pour la seconde partie de l’essai, le principal objectif est le suivant :
• Évaluer l’efficacité de l’association encorafénib et binimétinib sur ce groupe de cancers du poumon en mesurant la proportion de participants dont la tumeur a suffisamment régressé ou disparu après le traitement (taux de réponse objectif).
Cet essai permettra également :
• Pour les première et seconde parties, de décrire le profil de tolérance (effets secondaires) de l’encorafénib et du binimétinib et leur devenir dans l’organisme de leur prise jusqu’à leur élimination.
• Pour la seconde partie, d’approfondir l’évaluation de l’efficacité de l’association encorafénib et binimétinib en déterminant :
- La période pendant laquelle la tumeur continue de répondre au traitement (durée de la réponse).
- Le temps écoulé entre le début du traitement et l’aggravation de la maladie (survie sans progression).
- La durée de survie du participant à partir de l’initiation du traitement (survie globale).
Quels sont les traitements à l’étude et comment sont-ils administrés ?
Les participants traités avec la nouvelle thérapie reçoivent :
• 6 gélules d’encorafénib une fois par jour le matin. La dose quotidienne totale d’encorafénib est de 450 mg
• 3 comprimés de binimétinib deux fois par jour (matin et soir). La dose quotidienne totale de binimétinib est de 90 mg
