Essai visant à analyser la tolérance de l'encorafénib chez des participants originaires de Chine continentale atteints de tumeurs solides avancées avec mutation BRAFV600E
Essai visant à analyser la tolérance de l'encorafénib chez des participants originaires de Chine continentale atteints de tumeurs solides avancées avec mutation BRAFV600E

Étude multicentrique de phase I en ouvert évaluant la tolérance de l’encorafénib en monothérapie chez des participants chinois atteints de tumeurs métastatiques avancées solides avec mutation BRAFV600E
Comment l'essai se déroule-t-il ?
Il s'agit d'un essai en ouvert de phase 1 mené auprès de participants originaires de Chine continentale.
Un maximum de 6 participants chinois adultes (18 ans et plus) participe à cet essai.
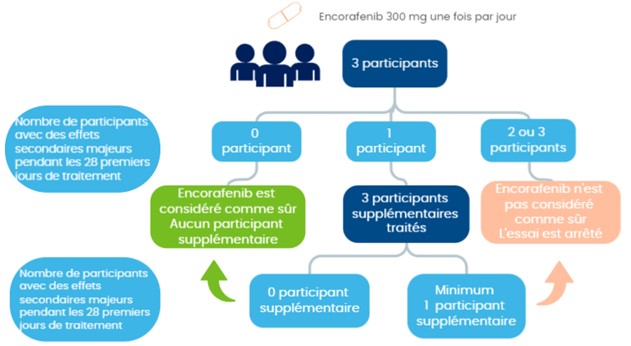
Dans un premier temps, trois participants prennent part à l'essai et sont traités par encorafénib. Après 28 jours (un cycle) de traitement chez les trois premiers participants, une analyse est effectuée pour étudier la tolérance de l'encorafénib :
- Si aucun participant ne présente d’effet secondaire majeur, aucun participant supplémentaire ne prend part à l'essai.
- Si un participant présente un effet secondaire majeur, trois (3) autres participants sont traités par encorafénib afin d'approfondir l’étude de la tolérance du traitement.
- Si deux (2) ou trois (3) participants présentent un effet secondaire majeur, l'encorafénib n'est pas considéré comme sûr, et l'essai est arrêté.
L'encorafénib est considéré comme suffisamment sûr si pas plus d'un participant n’a présenté d'effets secondaires majeurs.
Si le traitement est considéré comme suffisamment sûr, tous les participants sont traités par encorafénib jusqu’à ce qu’ils n’en tirent plus de bénéfices, autrement dit jusqu’à la progression de la tumeur ou du cancer.
Ce schéma synthétise les informations présentées ci-dessus :
Qui peut participer à cet essai ?
Pour participer à cet essai, les sujets doivent répondre à différents critères, parmi lesquels :
• Participants de Chine continentale âgés d’au moins 18 ans et atteints d’un cancer de la peau (mélanome) ou du poumon (cancer du poumon non à petites cellules) s’étant propagé à d’autres parties du corps (métastatique).
• La tumeur présente une mutation génétique spécifique appelée mutation BRAFV600E
• Le participant a déjà reçu un premier traitement pour son cancer métastatique
• Le participant n’a jamais reçu au préalable de traitement ciblant la mutation BRAF pour son cancer métastatique
• Le participant n’est pas enceinte ou allaitante.
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Le principal objectif de l’essai est le suivant :
• Étudier la tolérance (effets secondaires) de l'encorafénib 300 mg pendant les 28 premiers jours de traitement (premier cycle). Pour ce faire, on compte le nombre de participants chinois présentant des effets secondaires majeurs au cours des 28 premiers jours de traitement (premier cycle).
Cet essai permettra également :
• de décrire la tolérance de l'encorafénib 300 mg pendant la durée totale du traitement et son devenir dans l’organisme de sa prise jusqu’à son élimination (pharmacocinétique), en évaluant le nombre, la fréquence et le type d'effets secondaires survenus chez les participants jusqu'à 30 jours après la dernière dose de traitement.
Quels sont les traitements à l’étude et comment sont-ils administrés ?
Les participants reçoivent 4 gélules d’encorafénib une fois par jour le matin. La dose quotidienne totale d’encorafénib est de 300 mg.
