Essai visant à évaluer si encorafénib en association avec cétuximab est sûr et efficace pour la population chinoise atteinte d'un cancer colorectal métastatique avec mutation BRAFV600E
Essai visant à évaluer si encorafénib en association avec cétuximab est sûr et efficace pour la population chinoise atteinte d'un cancer colorectal métastatique avec mutation BRAFV600E

Un essai de phase 2 multicentrique randomisé en ouvert, avec phase de test de la tolérance (safety lead-in), évaluant l’association encorafénib et cétuximab versus irinotécan/cétuximab ou 5-fluorouracil (5-FU) /acide folinique (AF)/irinotécan (FOLFIRI)/cétuximab chez des participants chinois atteints de cancer colorectal métastatique avec mutation BRAFV600E.
Comment l'essai se déroule-t-il ?
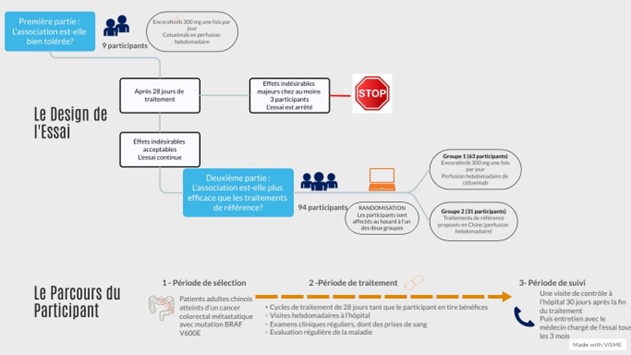
Il s’agit d'un essai de phase 2 en ouvert incluant 103 participants.
Pendant la première phase de l’essai, neuf (9) participants reçoivent l’association encorafénib + cétuximab.
Après 28 jours (un cycle) de traitement, la tolérance au traitement est évaluée.
Si au moins trois (3) participants présentent un effet secondaire majeur, la tolérance est considérée comme insuffisante et l’essai est interrompu
L’association est considérée comme sûre si moins de trois (3) participants présentent un effet secondaire majeur, la phase 2 peut alors commencer.
Quatre-vingt-quatorze (94) participants supplémentaires sont inclus dans la seconde phase de l’essai, et répartis en deux groupes de manière aléatoire (randomisation) :
• Deux tiers des participants (63) reçoivent l’association encorafénib + cétuximab.
• Un tiers des participants (31) reçoit les traitements de référence
Les deux phases de l’essai commencent par une étape de sélection pour vérifier que les participants répondent à tous les critères requis.
La période de traitement débute lors de l’administration de la première dose et consiste en :
• Des cycles de traitements successifs de 28 jours chacun, au cours desquels les traitements sont administrés conformément au protocole de l’essai
• Des évaluations régulières de la tolérance incluant des examens cliniques et analyses de sang
• Des évaluations régulières incluant des examens d’imagerie médicale pour contrôler la taille des tumeurs et l’évolution de la maladie.
Tous les participants continuent de recevoir le traitement tant qu'ils en bénéficient, c'est-à-dire tant que la maladie ne progresse pas, et qu’il est bien toléré.
La période de suivi débute à l’arrêt du traitement. Cette période consiste à surveiller la santé des participants dans le temps, et peut inclure, des examens cliniques, des analyses de sang et de l’imagerie médicale.
Ce schéma synthétise les informations présentées ci-dessus :
Qui peut participer à cet essai ?
Pour participer à cet essai, les sujets doivent répondre à différents critères, parmi lesquels :
Participants chinois âgés de ≥ 18 ans
La tumeur ne peut être retirée par chirurgie (non résécable)
La tumeur présente une mutation génétique spécifique appelée mutation BRAFV600E
Le participant a déjà reçu un à deux traitements pour son cancer métastatique
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Cet essai comporte 2 principaux objectifs, évalués lors de deux phases consécutives de l’essai :
• La première phase porte sur l’évaluation de la tolérance de l’association encorafénib + cétuximab. Pour ce faire, on compte dans un premier temps le nombre de participants ayant présenté un effet indésirable majeur dans les 28 premiers jours de traitement.
• La seconde phase consiste à comparer l’association encorafénib + cétuximab aux traitements de référence. L’efficacité est d’abord évaluée en analysant le temps écoulé entre le début du traitement et l’aggravation de la maladie.
Cet essai permettra également de :
• Décrire les effets secondaires sur la population chinoise, et de comparer le profil de tolérance de l’association à celui des traitements de référence.
• De décrire la façon dont l’encorafénib entre dans le corps, circule dans le sang et est éliminé.
• De comparer l’association aux traitements de référence en termes de survie, autrement dit le temps écoulé entre l’administration du traitement et le décès du participant (survie globale)
• De comparer les taux de réponse de l’association par rapport aux traitements de référence, autrement dit la proportion de participants dont la tumeur a régressé ou disparu après le traitement.
Quels sont les traitements à l’étude et comment sont-ils administrés ?
Les participants traités avec l’association reçoivent :
• 4 gélules d’encorafénib à prendre une fois par jour le matin. La dose quotidienne totale d’encorafénib est de 300 mg.
• Une perfusion hebdomadaire de cétuximab à l’hôpital.
Les participants recevant les traitements de référence reçoivent de l’irinotécan et du cétuximab ou du FOLFIRI et du cétuximab, selon le choix de l’investigateur. Ces traitements sont administrés par perfusion intraveineuse à l’hôpital (une fois par semaine pour le cétuximab, une fois toutes les deux semaines pour l’irinotécan et le FOLFIRI).
