Un essai prénatal pour les garçons atteints de Dysplasie Ectodermique Hypohidrotique liée à l'X (XLHED)
Un essai prénatal pour les garçons atteints de Dysplasie Ectodermique Hypohidrotique liée à l'X (XLHED)

Essai clinique multicentrique, prospectif, en ouvert, contrôlé par appariement génotypique, pour étudier l'efficacité et la tolérance du traitement prénatal par ER004 administré par voie intra-amniotique chez des sujets de sexe masculin atteints de dysplasie ectodermique hypohidrotique liée à l'X (XLHED).
Comment l'essai se déroule-t-il ?
Il s’agit d'un essai de phase II en ouvert.
Environ 20 femmes enceintes attendant un bébé de sexe masculin atteint de XLHED participeront à l'essai.
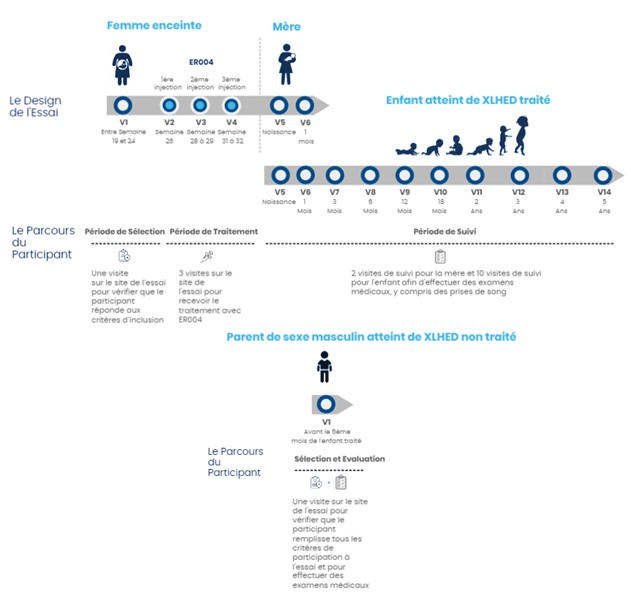
Cet essai portant sur des femmes enceintes et leur enfant atteint de XLHED se compose de 3 phases :
• Une période de sélection comprenant une visite au centre clinique pour vérifier que la femme enceinte et son fils à naître peuvent participer à l'essai. Au cours de cette visite, elle aura l'occasion de discuter avec le médecin investigateur avant de donner son consentement ou de décider de ne pas participer.
• Une période de traitement pendant laquelle la femme enceinte se rend 3 fois au centre clinique pour recevoir un total de 3 injections d'ER004 dans le liquide amniotique, à environ 3 semaines d'intervalle.
• Une période de suivi qui débute à la naissance du garçon traité et dure jusqu'à ses 5 ans. Des visites régulières au centre clinique sont programmées, au cours desquelles les médecins effectueront divers tests et mesures pour évaluer les effets du traitement et sa tolérance.
Le « Groupe comparateur » est constitué de membres de la famille de la femme enceinte, de sexe masculin et atteints de XLHED. Ce groupe ne sera pas traité avec l’ER004. Le parent de sexe masculin atteint de XLHED se rendra au centre clinique pour une seule visite, afin d'effectuer des examens médicaux non invasifs.
Ce schéma synthétise les informations présentées ci-dessus :
Qui peut participer à cet essai ?
Pour participer à cet essai, les participants doivent répondre à différents critères, parmi lesquels :
Groupe traité
• Femmes enceintes (âgées de 18 ans ou plus) ayant reçu un diagnostic génétique confirmé de XLHED ET attendant un petit garçon atteint de XLHED.
Groupe comparateur
• Parent de sexe masculin atteint de XLHED (âgé de 6 mois à 75 ans), n'ayant jamais reçu le traitement par ER004.
Quels sont les objectifs de l’essai, et comment sont-ils évalués ?
Le principal objectif de l’essai est le suivant :
• Évaluer l'efficacité du traitement prénatal avec l'ER004 sur la capacité de transpiration des garçons traités. Pour ce faire, on mesure la quantité de sueur produite par les garçons atteints de XLHED ayant reçu le traitement lors de différentes visites de suivi, jusqu’aux 5 ans de l’enfant.
Cet essai permettra également :
• D'évaluer si le traitement prénatal avec l'ER004 est bien toléré par la mère et par l'enfant. Pour ce faire, on évalue le nombre, la fréquence et le type d'effets secondaires observés chez la mère, jusqu'à 1 mois après l'accouchement, et chez l'enfant, jusqu'à ses 5 ans.
• D'évaluer l'efficacité de l'ER004 sur la croissance des dents des garçons atteints de XLHED ayant reçu le traitement, jusqu'à l'âge de 5 ans.
• D'évaluer les effets potentiels du traitement prénatal par l'ER004 sur les autres symptômes de la XLHED.
Quels sont les traitements à l’étude et comment sont-ils administrés ?
L'ER004 est un traitement administré avant la naissance, lors d'une procédure similaire à une amniocentèse. Trois séries d'injections dans le liquide amniotique sont effectuées au cours de 3 visites, à environ 3 semaines d'intervalle, aux 26e, 28-29e et 31-32e semaines de grossesse.
Aucune injection d’ER004 ne sera effectuée après la naissance de l’enfant.
En savoir plus
Articles de recherche du professeur Schneider et de ses collègues Schneider 2018; Schneider 2022
Lien vers le site internet dédié à l'essai clinique DELIFE : edelifeclinicaltrial.com
